点击展开
基因编辑犬模型
Gene editing dog model
背景信息
先天性黑蒙
先天性黑蒙症(Leber’s congenital amaurosis, LCA),是发生最早、最严重的遗传性视网膜病变,出生时或出生后一年内双眼锥杆细胞功能完全丧失,导致婴幼儿先天性盲。LCA占遗传性视网膜病变的5%以上,是导致儿童先天性盲的主要疾病(占10%-20%)。多呈常染色体隐性遗传,临床上以眼球震颤、固视障碍、畏光、指压眼球为特征。有研究发现数种与LCA相关的致病基因,主要包括RPE65,GUCY2D和CRX等。
英国伦敦大学学院的Bainbridge与美国宾夕法尼亚大学的Maguire同时发现用包含RPE65互补DNA(cDNA)的重组腺病毒伴随病毒(AAV)载体对LCA患者进行视网膜下注射,能够改善部分患者的视功能。早在2001年,研究者以重组AAV作为载体,将包含人RPE65编码序列和启动子区域序列的cDNA片段,从视网膜下注射入Rpe65自然突变的模型动物瑞典布里犬(Swedish Briard dog,该种犬存在Rpe65自然突变),通过这种基因治疗,可以改善该动物的视功能。
2
Rpe65基因
Rpe65基因敲出小鼠首次体内研究此基因功能,同时建立模拟人的LCA疾病模型,但遗憾的是由于物种差异,人类有杆状和椎体视觉细胞功能障碍,小鼠体内缺乏相应视觉细胞,因此小鼠表型与人的类患者区别明显,迫切需要更适合的动物模型。我们使用CRISPR/Cas9技术对Rpe65基因第5号外显子进行基因编辑,最终获得+7bp纯合子模型犬。
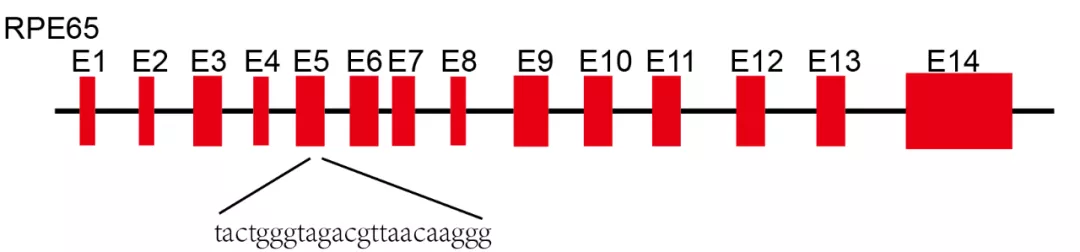
模型犬F0代结果
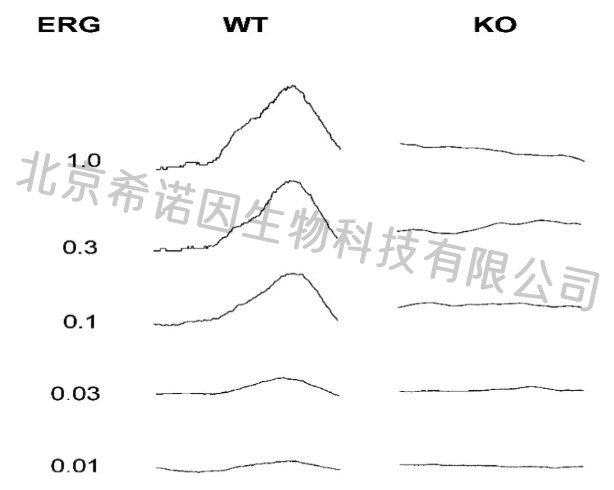
电生理异常
突变犬在2月、4月龄时对光刺激信号无反应(数据未发表)
2
模型应用
1. 评估干细胞对先天性黑蒙的治疗效果;
2. 评估基因治疗对先天性黑蒙的治疗效果等。